Общая характеристика. Свойства
В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р—элементы IV группы периодической системы Д.И. Менделеева. Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств.
Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так
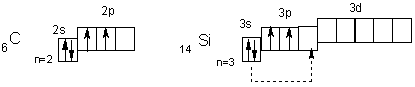
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s—подуровней (показано пунктирными стрелками).
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. Степень окисления -4 в последовательности C – Pb становится все менее характерной.
Свойства элементов подгруппы углерода
|
Свойства |
С |
Si |
Ge |
Sn |
Pb |
|
1. Порядковый номер |
6 |
14 |
32 |
50 |
82 |
|
2. Валентные электроны |
2s22p2 |
3s23р2 |
4s24р2 |
5s25р2 |
6s26р2 |
|
3. Энергия ионизации атома, эВ |
11,3 |
8,2 |
7,9 |
7,3 |
7,4 |
|
4. Относительная электроотрицательность |
2,50 |
1,74 |
2,02 |
1,72 |
1,55 |
|
5. Степень окисления в соединениях |
+4, +2, -4 |
+4, +2, -4 |
+4, -4 |
+4, +2, -4 |
+4, +2, -4 |
|
6. Радиус атома, нм |
0,077 |
0,134 |
0,139 |
0,158 |
0,175 |
Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения — формулы RН4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные — у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RН4: СН4 — прочное вещество, а PbH4 в свободном виде не выделено. В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус, т. е. неметаллические свойства ослабевают, а металлические усиливаются.
Химические свойства углерода и кремния. Графит и кремний — типичные восстановители . При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен) и кремний образуют диоксиды:
С + О2 = СО2,
Si + О2 = SiO2,
при недостатке кислорода можно получить монооксиды CO или SiO:
2С + О2 = 2СО,
2Si + O2 = 2SiO,
которые образуются также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО,
Si + SiO2 = 2SiO.
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании — с хлором, давая СCl4 и SiCl4. При более сильном нагревании углерод и кремний реагируют с серой и азотом:
4С + S8 = 4СS2,
2С + N2 = С2N2,
4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О,
3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3 + Н2↑.
Графит часто используют для восстановления малоактивных металлов из их оксидов:
СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si = Мg2Si + 2SiO.
Активные металлы — более сильные восстановители, чем углерод или кремний, поэтому последние при непосредственном взаимодействии с ними выступают в качестве окислителей
Са + 2С = СаС2,
2Mg + Si = Мg2Si.
