Галогены
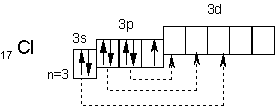
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат — радиоактивный элемент, изучен мало). Это р—элементы VII группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств. Свойства элементов подгруппы галогенов Свойства F Cl Br I At 1. Порядковый номер 9 17 35 53 85 2. Валентные электроны 2s22p5 3s23p5 4s24p5 5s25p5 6s26p5 3. Энергия ионизации атома, эВ 17,42 12,97 11,84 10,45 9,2 4. Относительная электроотрицательность 4,1 2,83…
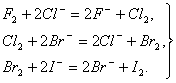
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например: 2Аl + 3F2 = 2АlF3 + 2989 кДж, 2Fе + 3F2 = 2FеF3 + 1974 кДж. Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например: Н2 + F2 = 2НF + 547 кДж, Si + 2F2 = SiF4(г) + 1615 кДж. При нагревании фтор окисляет все другие галогены по схеме Hal2 + F2 = 2НаlF где Наl = Сl, Вr,…
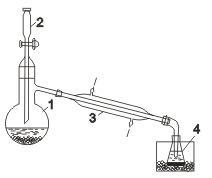
Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом. При электролизе расплава хлорида натрия (Тпл = 801°С) на катоде выделяется металлический натрий, а на аноде — газообразный хлор. Электролитическая ванна (электролизер) представляет собой футерованный огнеупорным кирпичом стальной сосуд. В качестве анода используют графитовые стержни, в качестве катода — стальной цилиндр. В верхней части ванны имеется устройство для сбора хлора (колокол). Выделяющийся в катодном пространстве металлический натрий собирают в коллектор (устройство для сбора натрия без доступа воздуха). Таким образом, электролиз расплава NaCl — способ одновременного получения хлора и металлического натрия. Электролизом водного раствора NаСl получают одновременно Н2, Сl2 и гидроксид натрия NаОН. Обычно электролизу подвергают насыщенный водный раствор NaCl (рассол), подаваемый в электролизер сверху. Электролиз протекает по следующей схеме: NaCl Na+ + Сl— Н2О Н+ + ОН— ↓ ↓ ↓ (-) Катод (+) Анод 2Н+ + 2е =…

Галогеноводороды, галогеноводородные кислоты и галогениды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемая в их молекулах, — ковалентная полярная, причем полярность связи в ряду НF — НСl — НВr — НI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности, все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить 400 объемов НСl, 530 объемов НВr и около 400 HI. Свойства галогеноводородов Галогено-водород Температура плавления оС Температура кипения оС Энергия связи кДж/моль Константа диссоциации кислоты НF —80 20 562 6,7∙10—4 НСl -115 -85 431 1.107 НВr -89 -67 366…
