Неорганическая химия
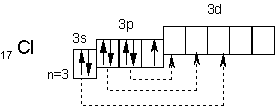
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат — радиоактивный элемент, изучен мало). Это р—элементы VII группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств. Свойства элементов подгруппы галогенов Свойства F Cl Br I At 1. Порядковый номер 9 17 35 53 85 2. Валентные электроны 2s22p5 3s23p5 4s24p5 5s25p5 6s26p5 3. Энергия ионизации атома, эВ 17,42 12,97 11,84 10,45 9,2 4. Относительная электроотрицательность 4,1 2,83…
Оксид кремния (IV) и кремниевые кислоты
Оксид кремния SiO2 — твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе, где оно встречается главным образом в виде минерала кварца, а также кристобалита и тридимита. При обычных температурах устойчивой модификацией является кварц, с ростом температуры наблюдаются полиморфные превращения: Кремнезем всех модификаций в виде мономера не существует; он всегда полимерен…
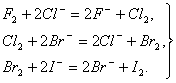
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например: 2Аl + 3F2 = 2АlF3 + 2989 кДж, 2Fе + 3F2 = 2FеF3 + 1974 кДж. Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например: Н2 + F2 = 2НF + 547 кДж, Si + 2F2 = SiF4(г) + 1615 кДж. При нагревании фтор окисляет все другие галогены по схеме Hal2 + F2 = 2НаlF где Наl = Сl, Вr,…
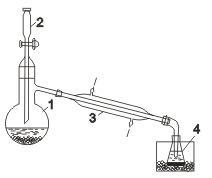
Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом. При электролизе расплава хлорида натрия (Тпл = 801°С) на катоде выделяется металлический натрий, а на аноде — газообразный хлор. Электролитическая ванна (электролизер) представляет собой футерованный огнеупорным кирпичом стальной сосуд. В качестве анода используют графитовые стержни, в качестве катода — стальной цилиндр. В верхней части ванны имеется устройство для сбора хлора (колокол). Выделяющийся в катодном пространстве металлический натрий собирают в коллектор (устройство для сбора натрия без доступа воздуха). Таким образом, электролиз расплава NaCl — способ одновременного получения хлора и металлического натрия. Электролизом водного раствора NаСl получают одновременно Н2, Сl2 и гидроксид натрия NаОН. Обычно электролизу подвергают насыщенный водный раствор NaCl (рассол), подаваемый в электролизер сверху. Электролиз протекает по следующей схеме: NaCl Na+ + Сl— Н2О Н+ + ОН— ↓ ↓ ↓ (-) Катод (+) Анод 2Н+ + 2е =…

Галогеноводороды, галогеноводородные кислоты и галогениды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемая в их молекулах, — ковалентная полярная, причем полярность связи в ряду НF — НСl — НВr — НI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности, все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить 400 объемов НСl, 530 объемов НВr и около 400 HI. Свойства галогеноводородов Галогено-водород Температура плавления оС Температура кипения оС Энергия связи кДж/моль Константа диссоциации кислоты НF —80 20 562 6,7∙10—4 НСl -115 -85 431 1.107 НВr -89 -67 366…
Кислород — второй по электроотрицательности элемент после фтора, поэтому он проявляет сильные окислительные свойства. С большинством металлов он реагирует уже при комнатной температуре, образуя основные оксиды. С неметаллами (за исключением гелия, неона, аргона) кислород реагирует, как правило, при нагревании. Так, с фосфором он реагирует при температуре ~ 60 °С, образуя Р2О5, с серой — при температуре около 250 °С: S + О2 = SO2. С графитом кислород реагирует при 700 °С С + О2 = СО2. Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде N2 + О2 2NО — Q. Кислород реагирует и со многими сложными соединениями, например с оксидом азота (II) он реагирует уже при комнатной температуре: 2NО + О2…
В промышленности кислород получают: 1) фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается); 2) электролизом воды. Ежегодно во всем мире получают свыше 80 млн. т кислорода. В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов: 2КМnО4 К2MnО4 + МnО2 + О2↑, 4К2Сr2О7 4К2CrO4 + 2Сr2О3 + 3O2↑, 2КNО3 2КNО2 + О2↑, 2Pb3О4 6PbО + О2↑,…
В обычных условиях — бесцветный газ, с резким запахом (запахом «нашатыря»); сжижается при -33,4 °С и затвердевает при -77,7 °С. Молекула аммиака имеет форму пирамиды, в жидком аммиаке молекулы NН3 связаны водородными связями, обусловливая тем самым аномально высокую температуру кипения. Полярные молекулы NH3 очень хорошо растворимы в воде (700 объемов NН3 в одном объеме Н2О)…
Фосфор образует два хлорида: трихлорид фосфора PCl3 и пентахлорид фосфора РCl5. Трихлорид фосфора получают, пропуская хлор над поверхностью белого фосфора. При этом фосфор горит бледно-зеленым пламенем, а образующийся хлорид фосфора конденсируется в виде бесцветной жидкости. Трихлорид фосфора гидролизуется водой с образованием фосфористой кислоты и хлороводорода: РCl3 + ЗН2О = Н3РО3 + ЗНСl. Пентахлорид фосфора можно получить в лабораторных условиях…
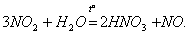
В оксидах степень окисления азота меняется от +1 до +5. Оксиды N2О и NO — бесцветные газы, оксид азот (IV) NO2 — бурый газ, получивший в промышленности название «лисий хвост». Оксид азота (III) N2О3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы. Часто используется тривиальное название оксида азота (I)…
