Превращение CO2 в углеродные соединения
Исследователи обнаружили, что капля молекулярного клея и своевременный поворот помогают бактериальному ферменту превращать углекислый газ в углеродные соединения в 20 раз быстрее, чем ферменты растений во время фотосинтеза. Результаты должны ускорить прогресс в преобразовании углекислого газа в различные продукты.
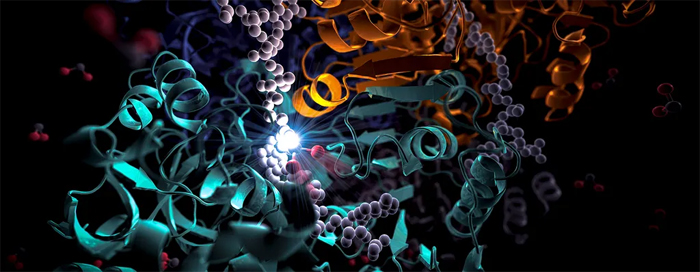
Художественная интерпретация фермента. Предоставлено: Национальная ускорительная лаборатория SLAC.
Фиксация углерода или преобразование углекислого газа из воздуха в богатые углеродом биомолекулы необходимы для выживания растений. В этом весь смысл фотосинтеза и краеугольного камня обширной взаимосвязанной системы, которая обеспечивает круговорот углерода в растениях, животных, микробах и атмосфере для поддержания жизни на Земле.
Однако чемпионами по фиксации углерода являются почвенные бактерии, а не растения.
- Ученые могут разработать искусственный фотосинтез для преобразования парниковых газов в топливо, удобрения, антибиотики и другие продукты, если они смогут выяснить, как определенные бактериальные ферменты выполняют жизненно важный этап фиксации углерода в 20 раз быстрее, чем ферменты растений.
- Теперь группа исследователей из Национальной ускорительной лаборатории SLAC Министерства энергетики , Стэнфордского университета , Института наземной микробиологии им. Макса Планка в Германии, Объединенного института генома Министерства энергетики (JGI) и Университета Консепсьон в Чили открыла, как бактериальный фермент — молекулярный машина, которая способствует химическим реакциям — набирает обороты, чтобы совершить этот подвиг.
- Вместо того, чтобы захватывать молекулы углекислого газа и присоединять их к биомолекулам по одной, они обнаружили, что этот фермент состоит из пар молекул, которые работают синхронно, как руки жонглера, который одновременно подбрасывает и ловит мячи, чтобы выполнить работу быстрее. Один член каждой пары ферментов широко открывается, чтобы уловить набор ингредиентов реакции, в то время как другой закрывается для захваченных ингредиентов и выполняет реакцию связывания углерода; затем они меняются ролями в непрерывном цикле.
Исследователи обнаружили, что одна точка молекулярного «клея» скрепляет каждую пару ферментных ручек, чтобы они могли попеременно открывать и закрывать скоординированным образом, в то время как вращательное движение помогает перемещать ингредиенты и готовые продукты в карманы, где происходят реакции, и из них. происходит. Когда присутствуют и клей, и крутка, реакция фиксации углерода идет в 100 раз быстрее, чем без них.
ECR Фермент SLAC
«Этот бактериальный фермент является наиболее эффективным фиксатором углерода, о котором мы знаем, и мы придумали четкое объяснение того, что он может делать», — сказал Соичи Вакацуки, профессор SLAC и Стэнфорда и один из старших руководителей исследования которая была опубликована в ACS Central Science на этой неделе.
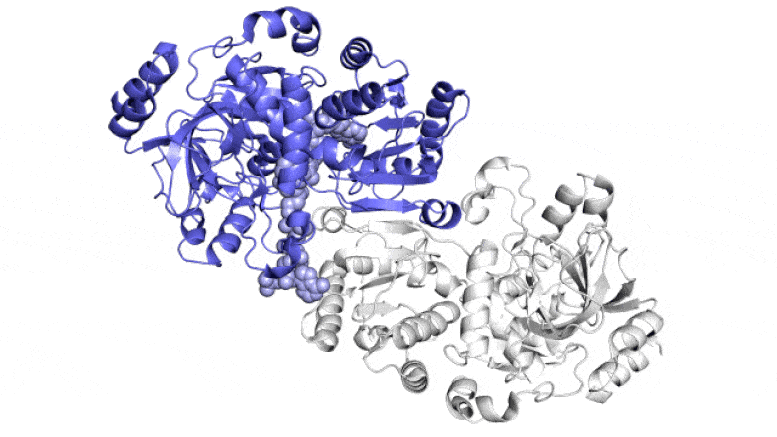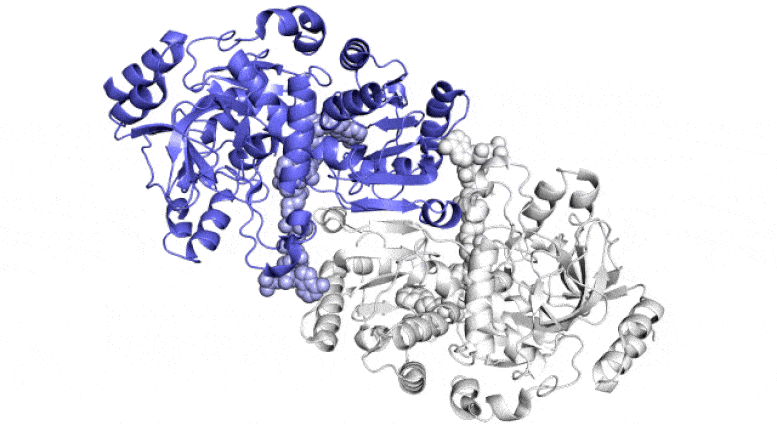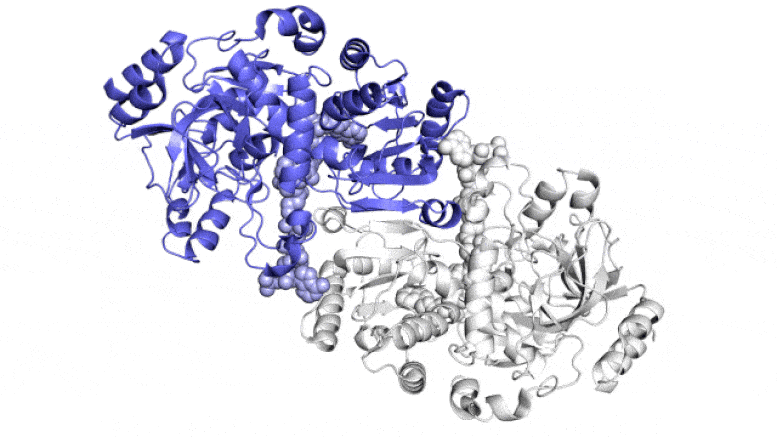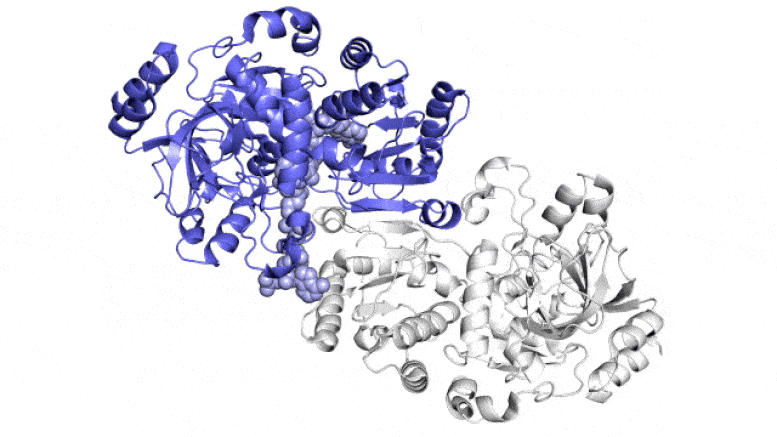
На этой анимации показаны две парные молекулы (синяя и белая) внутри фермента ECR, который фиксирует углерод в почвенных микробах, в действии. Они работают вместе, как руки жонглера, который одновременно подбрасывает и ловит мячи, чтобы быстрее выполнить работу. Один член каждой пары ферментов широко открывается, чтобы уловить набор ингредиентов реакции (показан поступающий сверху и снизу), в то время как другой член закрывается для захваченных ингредиентов и выполняет реакцию связывания углерода; затем они меняются ролями в непрерывном цикле. Ученые пытаются использовать и улучшить эти реакции для искусственного фотосинтеза, чтобы производить различные продукты. Авторы и права: Х. ДеМирси и др., ACS Central Science , 2022 г.
«Некоторые ферменты этого семейства действуют медленно, но очень специфическим образом, производя только один продукт», — сказал он. «Другие намного быстрее и могут создавать химические строительные блоки для всех видов продуктов. Теперь, когда мы знаем механизм, мы можем создавать ферменты, которые сочетают в себе лучшие черты обоих подходов и очень быстро справляются со всеми видами исходных материалов».
Улучшение природы
Фермент, который исследовала команда, является частью семейства эноил-КоА-карбоксилаз/редуктаз, или ECR. Он происходит от почвенных бактерий под названием Kitasatospora setae, которые в дополнение к своим способностям связывать углерод также могут производить антибиотики.
Вакацуки услышал об этом семействе ферментов полдюжины лет назад от Тобиаса Эрба из Института наземной микробиологии им. Макса Планка в Германии и Ясуо Йошикуни из JGI. Исследовательская группа Эрба работала над созданием биореакторов для искусственного фотосинтеза для преобразования углекислого газа (CO2) из атмосферы во всевозможные продукты.
Как бы ни был важен фотосинтез для жизни на Земле, по словам Эрба, он не очень эффективен. Как и все, что формировалось эволюцией на протяжении тысячелетий, оно настолько хорошо, насколько должно быть, результат медленного развития предыдущих разработок, но никогда не изобретения чего-то совершенно нового с нуля.
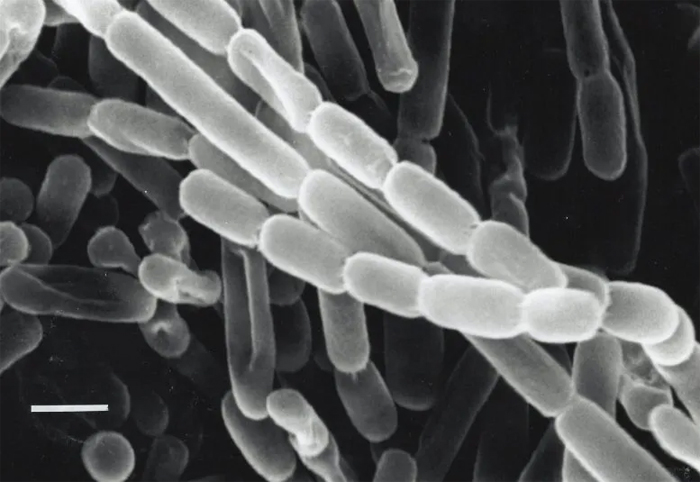
Крупный план щетинок Kitasatospora, бактерии, выделенной из почвы в Японии. Эти бактерии фиксируют углерод — превращают углекислый газ из окружающей среды в биомолекулы, необходимые им для выживания — благодаря ферментам, называемым ECR. Исследователи ищут способы использовать и улучшить ECR для искусственного фотосинтеза для производства топлива, антибиотиков и других продуктов. Фото: Ю. Такахаши и Ю. Иваи, atlas.actino.jp
Более того, по его словам, этап естественного фотосинтеза, фиксирующий СО2 из воздуха, основанный на ферменте Rubisco, является узким местом, тормозящим всю цепочку фотосинтетических реакций. Таким образом, использование быстрых ферментов ECR для выполнения этого шага и разработка их так, чтобы они работали еще быстрее, может значительно повысить эффективность.
«Мы не пытаемся сделать точную копию фотосинтеза, — объяснил Эрб. «Мы хотим разработать гораздо более эффективный процесс, используя наше понимание инженерии, чтобы перестроить представления о природе. Этот «фотосинтез 2.0» может иметь место в живых или синтетических системах, таких как искусственные хлоропласты — капли воды, взвешенные в масле».
Портреты фермента
Вакацуки и его группа исследовали родственную систему — фиксацию азота, которая превращает газообразный азот из атмосферы в соединения, необходимые живым существам. Заинтригованный вопросом, почему ферменты ECR были такими быстрыми, он начал сотрудничать с группой Эрба, чтобы найти ответы.
Хасан ДеМирчи, научный сотрудник группы Вакацуки, который в настоящее время является доцентом Университета Кока и исследователем Стэнфордского института PULSE, руководил работой в SLAC с помощью полудюжины летних стажеров SLAC, которых он курировал. «Каждый год мы тренируем шесть или семь из них, и они были бесстрашны», — сказал он. «Они пришли с открытым сознанием, готовые учиться, и они сделали удивительные вещи».
Команда SLAC сделала образцы фермента ECR и кристаллизовала их для исследования с помощью рентгеновских лучей на усовершенствованном источнике фотонов в Аргоннской национальной лаборатории Министерства энергетики США. Рентгеновские снимки выявили молекулярную структуру фермента — расположение его атомных каркасов — как в отдельности, так и при присоединении к небольшой молекуле-помощнику, облегчающей его работу.
Дальнейшие рентгеновские исследования в Стэнфордском источнике синхротронного излучения (SSRL) SLAC показали, как структура фермента смещалась, когда он прикреплялся к субстрату, своего рода молекулярному рабочему столу, который собирает ингредиенты для реакции фиксации углерода и подстегивает реакцию.
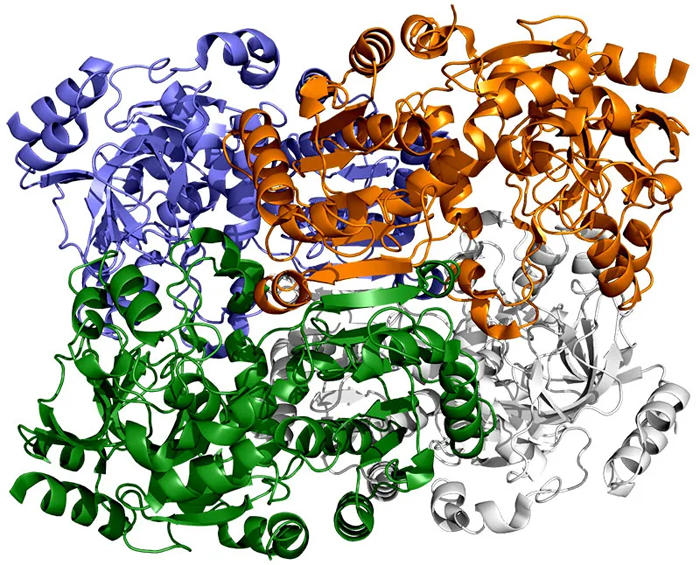
На этом изображении ECR, фермента, обнаруженного в почвенных бактериях, каждая из его четырех идентичных молекул показана разным цветом. Эти молекулы работают вместе попарно — синий с белым и зеленый с оранжевым — превращая углекислый газ из окружающей среды микроба в биомолекулы, необходимые ему для выживания. Новое исследование показывает, что пятно молекулярного клея и своевременный поворот и скручивание позволяют этим парам синхронизировать свои движения и фиксировать углерод в 20 раз быстрее, чем это делают растительные ферменты во время фотосинтеза. Авторы и права: Х. ДеМирси и др., ACS Central Science , 2022 г.
Наконец, группа исследователей из Linac Coherent Light Source (LCLS) SLAC провела более подробные исследования фермента и его субстрата на японском рентгеновском лазере на свободных электронах SACLA. Выбор рентгеновского лазера был важен, потому что он позволил им изучить поведение фермента при комнатной температуре — ближе к его естественной среде — почти без радиационного повреждения.
Тем временем группа Эрба в Германии и группа доцента Эстебана Ворингера-Мартинеса из Университета Консепсьон в Чили провели детальные биохимические исследования и масштабное динамическое моделирование, чтобы разобраться в структурных данных, собранных Вакацуки и его командой.
По словам Вакацуки, моделирование показало, что открытие и закрытие двух частей фермента включает не только молекулярный клей, но и вращательные движения вокруг центральной оси каждой пары ферментов.
«Этот поворот похож на храповик, который может вытолкнуть готовый продукт или вытащить новый набор ингредиентов в карман, где происходит реакция», — сказал он. Вместе скручивание и синхронизация пар ферментов позволяют им фиксировать углерод 100 раз в секунду.
Семейство ферментов ECR также включает более универсальную ветвь, которая может взаимодействовать со многими различными видами биомолекул для получения различных продуктов. Но поскольку они не скреплены молекулярным клеем, они не могут координировать свои движения и поэтому действуют гораздо медленнее.
«Если мы сможем увеличить скорость этих сложных реакций для создания новых биомолекул, — сказал Вакацуки, — это будет значительный скачок в этой области».
От статичных кадров к плавным фильмам
На данный момент в ходе экспериментов были получены статические снимки фермента, ингредиентов реакции и конечных продуктов в различных конфигурациях.
«Эксперимент нашей мечты, — сказал Вакацуки, — заключался в том, чтобы объединить все ингредиенты, когда они попадают на путь рентгеновского лазерного луча, чтобы мы могли наблюдать за реакцией в реальном времени».
По его словам, команда на самом деле пробовала это в SACLA, но это не сработало. «Молекулы CO2 очень маленькие, и они движутся так быстро, что трудно уловить момент, когда они прикрепляются к субстрату», — сказал он. «Кроме того, рентгеновский лазерный луч настолько силен, что мы не могли удерживать ингредиенты в нем достаточно долго, чтобы произошла реакция. Когда мы сильно надавили, нам удалось разбить кристаллы».
Он добавил, что грядущее высокоэнергетическое обновление до LCLS, вероятно, решит эту проблему благодаря импульсам, которые поступают гораздо чаще — миллион раз в секунду — и могут быть индивидуально настроены на идеальную силу для каждого образца.
Вакацуки сказал, что его команда продолжает сотрудничать с группой Эрба и работает с группой доставки образцов LCLS и с исследователями из SLAC-Stanford криогенной электронной микроскопии (крио-ЭМ), чтобы найти способ заставить этот подход работать.
Исследователи из Центра RIKEN Spring-8 и Японского научно-исследовательского института синхротронного излучения также внесли свой вклад в эту работу, которая получила значительное финансирование от Управления науки Министерства энергетики США. Большая часть предварительной работы для этого исследования была выполнена летним стажером SLAC Яшем Рао; Стажеры Брэндон Хейс, Э. Хан Дао и Манат Каур также внесли ключевой вклад. Объединенный институт генома Министерства энергетики предоставил ДНК, используемую для производства образцов ECR. SSRL, LCLS, Advanced Photon Source и Объединенный институт генома — все это объекты для пользователей Управления науки Министерства энергетики США.
Метки: Молекулярная Биология
- Превращение пластикового мусора в химическое сокровище
- Истинный механизм аммиачного катализа
- Катализатор, превращающий воду в энергетическое богатство
- Жидкие металлы меняют процессы химического машиностроения
- Влияние электричества на химический синтез
- Прорыв в области электрокатализаторов для производства H2O2
- Раскрытие атомных тайн распада металла
- Преобразование сельского хозяйства с помощью микробных удобрений
- Уничтожение прочных пластиковых соединений
- Возрождения метода Барбье с помощью механохимией
