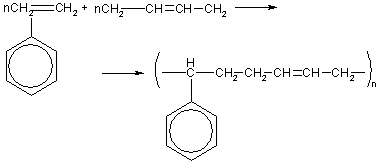
Промышленный спрос на каучук значительно превосходит возможности его природных источников, поэтому химикам пришлось решать проблему синтеза каучука, не уступающего по свойствам натуральному продукту. Первый промышленный синтетический каучук был получен в России в 1931 г. Профессор С.В.Лебедев открыл экономичный способ производства бутадиена из этилового спирта и осуществил полимеризацию бутадиена по радикальному механизму в присутствии металлического натрия:…
Чай и молоко лучше пить по раздельности

Многие любят пить чай, добавляя в него молоко. О вкусах не спорят, однако многим, в том числе и мне, этот вкус никогда не нравился. И вот, в опубликованной 9 января в сети статье из журнала European Heart Journal исследователи из Германии сообщают, что молоко нейтрализует полезное действие чая на организм. Предыдущие исследования показали, что потребление…
Место водорода в периодической системе

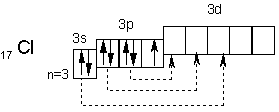
Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома окружено электронным облаком. Электронная конфигурация 1s1. В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон). Однако по свойствам он более сходен с галогенами, чем со щелочными металлами. Поэтому водород помещают в VII группу…
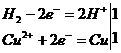
Физические свойства. Водород — это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен. Кроме водорода с массовым числом 1 существуют…

В лабораторных условиях водород получают следующими способами. 1. Взаимодействием металла (цинка) с растворами соляной и серной кислот (реакция проводится в аппарате Киппа): Zn + 2Н+ = Zn2+ + Н2↑ 2. Электролизом воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода. В промышленности водород получают…

Вода — наиболее распространенное соединение на Земле. Ее количество достигает 1018 т, и она покрывает приблизительно четыре пятых земной поверхности. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды. Содержание воды в некоторых пищевых продуктах Пищевые продукты Содержание воды, масс. % Помидоры Грибы Молоко Апельсины Яблоки Рыба Картофель Яйца Мясо (говядина) 95 92 87 86 84 82 76 75 64…
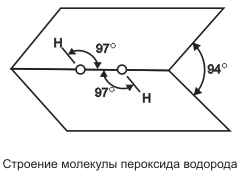
Пероксид водорода (перекись водорода) Н2О2 — тяжелая полярная жидкость голубоватого цвета, строение которой показано на . В жидком состоянии молекулы пероксида водорода сильно ассоциированы благодаря водородным связям. Поскольку пероксид водорода имеет больше возможностей к образованию таких связей (ввиду большего числа атомов кислорода на один атом водорода), чем вода, то он имеет большие плотность, вязкость и температуру кипения (150,2°С). Пероксид водорода смешивается с водой во всех отношениях, чистый Н2О2 и весьма концентрированные растворы взрываются на свету; 30%-ный раствор пероксида водорода в воде имеет техническое название «пергидроль». Пероксид водорода каталитически разлагается при комнатной температуре, выделяя в первый момент атомарный кислород. На этом основано использование 3%-ного раствора Н2О2 в медицине. Пероксид водорода вступает в реакции трех типов: без изменения пероксидной группировки: Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О, в качестве восстановителя: 2KMnО4 + 5Н2О2 + ЗН2SО4 = 2MnSО4 + К2SО4 + 5О2 + 8Н2O,…
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат — радиоактивный элемент, изучен мало). Это р—элементы VII группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств. Свойства элементов подгруппы галогенов Свойства F Cl Br I At 1. Порядковый номер 9 17 35 53 85 2. Валентные электроны 2s22p5 3s23p5 4s24p5 5s25p5 6s26p5 3. Энергия ионизации атома, эВ 17,42 12,97 11,84 10,45 9,2 4. Относительная электроотрицательность 4,1 2,83…
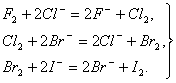
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например: 2Аl + 3F2 = 2АlF3 + 2989 кДж, 2Fе + 3F2 = 2FеF3 + 1974 кДж. Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например: Н2 + F2 = 2НF + 547 кДж, Si + 2F2 = SiF4(г) + 1615 кДж. При нагревании фтор окисляет все другие галогены по схеме Hal2 + F2 = 2НаlF где Наl = Сl, Вr,…
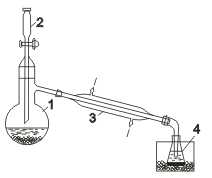
Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом. При электролизе расплава хлорида натрия (Тпл = 801°С) на катоде выделяется металлический натрий, а на аноде — газообразный хлор. Электролитическая ванна (электролизер) представляет собой футерованный огнеупорным кирпичом стальной сосуд. В качестве анода используют графитовые стержни, в качестве катода — стальной цилиндр. В верхней части ванны имеется устройство для сбора хлора (колокол). Выделяющийся в катодном пространстве металлический натрий собирают в коллектор (устройство для сбора натрия без доступа воздуха). Таким образом, электролиз расплава NaCl — способ одновременного получения хлора и металлического натрия. Электролизом водного раствора NаСl получают одновременно Н2, Сl2 и гидроксид натрия NаОН. Обычно электролизу подвергают насыщенный водный раствор NaCl (рассол), подаваемый в электролизер сверху. Электролиз протекает по следующей схеме: NaCl Na+ + Сl— Н2О Н+ + ОН— ↓ ↓ ↓ (-) Катод (+) Анод 2Н+ + 2е =…
