
Галогеноводороды, галогеноводородные кислоты и галогениды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемая в их молекулах, — ковалентная полярная, причем полярность связи в ряду НF — НСl — НВr — НI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности, все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить 400 объемов НСl, 530 объемов НВr и около 400 HI. Свойства галогеноводородов Галогено-водород Температура плавления оС Температура кипения оС Энергия связи кДж/моль Константа диссоциации кислоты НF —80 20 562 6,7∙10—4 НСl -115 -85 431 1.107 НВr -89 -67 366…
Кислород — второй по электроотрицательности элемент после фтора, поэтому он проявляет сильные окислительные свойства. С большинством металлов он реагирует уже при комнатной температуре, образуя основные оксиды. С неметаллами (за исключением гелия, неона, аргона) кислород реагирует, как правило, при нагревании. Так, с фосфором он реагирует при температуре ~ 60 °С, образуя Р2О5, с серой — при температуре около 250 °С: S + О2 = SO2. С графитом кислород реагирует при 700 °С С + О2 = СО2. Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде N2 + О2 2NО — Q. Кислород реагирует и со многими сложными соединениями, например с оксидом азота (II) он реагирует уже при комнатной температуре: 2NО + О2…
В промышленности кислород получают: 1) фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается); 2) электролизом воды. Ежегодно во всем мире получают свыше 80 млн. т кислорода. В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов: 2КМnО4 К2MnО4 + МnО2 + О2↑, 4К2Сr2О7 4К2CrO4 + 2Сr2О3 + 3O2↑, 2КNО3 2КNО2 + О2↑, 2Pb3О4 6PbО + О2↑,…
В обычных условиях — бесцветный газ, с резким запахом (запахом «нашатыря»); сжижается при -33,4 °С и затвердевает при -77,7 °С. Молекула аммиака имеет форму пирамиды, в жидком аммиаке молекулы NН3 связаны водородными связями, обусловливая тем самым аномально высокую температуру кипения. Полярные молекулы NH3 очень хорошо растворимы в воде (700 объемов NН3 в одном объеме Н2О)…
Фосфор образует два хлорида: трихлорид фосфора PCl3 и пентахлорид фосфора РCl5. Трихлорид фосфора получают, пропуская хлор над поверхностью белого фосфора. При этом фосфор горит бледно-зеленым пламенем, а образующийся хлорид фосфора конденсируется в виде бесцветной жидкости. Трихлорид фосфора гидролизуется водой с образованием фосфористой кислоты и хлороводорода: РCl3 + ЗН2О = Н3РО3 + ЗНСl. Пентахлорид фосфора можно получить в лабораторных условиях…
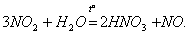
В оксидах степень окисления азота меняется от +1 до +5. Оксиды N2О и NO — бесцветные газы, оксид азот (IV) NO2 — бурый газ, получивший в промышленности название «лисий хвост». Оксид азота (III) N2О3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы. Часто используется тривиальное название оксида азота (I)…

Фосфорный ангидрид Р2О5 («простейшая» формула) является наиболее стабильным оксидом фосфора при обычных условиях. Это — твердое белое вещество состава Р4О10. Фосфористый ангидрид описывается простейшей формулой Р2O3 и истинной формулой Р4О6. Показано, что фосфор в Р4О6 координационно ненасыщен, и поэтому является неустойчивым. Взаимодействие Р4О6 с горячей водой приводит к диспропорционированию Р4О6 + 6Н2О = РН3↑ + ЗН3РО4; Газообразный НСl разлагает Р4О6: Р4О6 + 6НСl = 2Н3РО3 + 2РСl3. Р4О10 активно взаимодействует с водой, а также отнимает ее от других соединений, образуя в зависимости от условий, либо метафосфорную НРО3, либо ортофосфорную Н3РО4, либо пирофосфорную Н4Р2О7 кислоты. Именно поэтому Р4О10 широко используется как осушитель различных веществ от паров воды.

Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде. Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет: 4НNО3 = 4NО2 + 2Н2О + О2. Азотная кислота принадлежит к числу…

При нагревании твердых нитратов все они разлагаются с выделением кислорода (исключением является нитрат аммония), при этом их можно разделить на четыре группы. Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород: 2КNО3 = 2КNО2 + О2↑. Вторую группу составляет большинство нитратов (от щелочноземельных металлов до меди включительно), разлагающихся на оксид металла, NО2 и кислород: 2Сu(NО3)2 = 2СuО + 4NО2 + O2, Третью группу составляют нитраты наиболее тяжелых металлов (АgNО3 и Нg(NО3)2), разлагающиеся до свободного металла, NО2 и кислорода: Hg(NО3)2 = Нg + 2NО2 + О2, Четвертую «группу» составляет нитрат аммония: NН4NО3 = N2О + 2Н2O.
Азотистая кислота НNО2 принадлежит к слабым кислотам (К = 6.10-4 при 25 °С), неустойчива и известна лишь в разбавленных растворах, в которых осуществляется равновесие 2НNО2 NО + NО2 + Н2О. Нитриты в отличие от самой кислоты устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду.
