Физические свойства. При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С16) — жидкости, начиная с C17 — твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов. Получение. 1. Основной способ получения циклоалканов — отщепление двух атомов галогена от дигалогеналканов: 2. При каталитическом гидрировании ароматических углеводородов образуются…
Флуоресценция упрощает контроль расхода борных кислот

В одном из предновогодних выпусков новостей приводилась «горячая десятка» химиков, работы которых цитировались наибольшее количество раз. Десятое место в этом списке принадлежит профессору Химического факультета Массачусетского Технологического Института (MIT) Стефану Бухвальду (Stephen L. Buchwald). Возможно, что разработанный Бухвальдом и Тимоти Бардером (Timothy E. Barder) метод контроля за расходом борных кислот в катализируемых металлокомплексами реакциях кросс-сочетания…
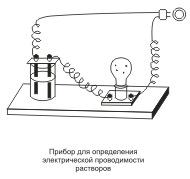
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора . Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений,…
Теория электролитической диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям: 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3—, SO2-4, РОЗ-4и т.д.). 2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. 3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например,…
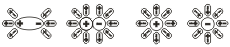
Существенным является вопрос о механизме электролитической диссоциации. Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При…
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н3РО4 Н+ + Н2РО—4(первая ступень) Н2РО—4 Н+ + НРO2-4 (вторая ступень) НРО2-4 Н+ PОЗ—4 (третья ступень) Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4. Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH K+ + OH—;…
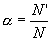
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α). Степень диссоциации — это отношение числа распавшихся на ионы молекул N’ к общему числу растворенных молекул N: Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы. Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита,…
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер. При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак ↓, стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется из сферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные, записывают в виде ионов. Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. Для закрепления этих положений рассмотрим два примера. Пример 1. Напишите уравнения реакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах. Разобьем решение задачи на четыре этапа. 1….
Ионное произведение воды. pH раствора
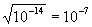
КH2O = 1.10-4 Данная константа для воды называется ионным произведением воды, которое зависит только от температуры. При диссоциации воды на каждый ион Н+ образуется один ион ОН—, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН—]. Используя значение ионного произведения воды, находим: [H+] = [ОН—] = моль/л. Таковы концентрации ионов Н+ и ОН—…
Выше показано, что реакция чистой воды является нейтральной (рН = 7). Водные растворы кислот и оснований имеют, соответственно, кислую (рН < 7) и щелочную (рН > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию — причиной этого является гидролиз солей. Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей. Рассмотрим гидролиз солей следующих основных типов: 1. Соли сильного основания и сильной кислоты (например, KBr, NаNО3) при растворении в воде не гидролизуются, и раствор соли имеет нейтральную реакцию….
