
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов (Сl, S и т.д.). Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются: СаСО3 = СаО + СО2, 2Ag2СОЗ = 4Аg + 2СО2 + О2, NН4Сl = NН3 + НСl, 2КNОЗ = 2КNО2 + О2, 2FеSО4 = Fе2О3 + SО2 + SО3, 4FеSО4 = 2Fе2ОЗ + 4SО2 + О2, 2Сu(NО3)2 = 2СuО +…
Глицерин как новое сырье для химического производства

В связи с истощением мировых запасов нефти и другого природного углеводородного сырья практически во всех индустриально развитых странах идут поиски альтернативных источников топлива для удовлетворения запросов энергетики и транспорта. В последнее время популярным стало использование биодизельного топлива, основа химического получения которого заключается в метанолизе растительных масел. Увеличение производства биодизеля приводит к образованию больших количеств сопутствующего…
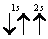
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: В атоме не может быть двух электронов, у которых все…
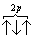
При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях: В этом случае суммарный спин равен 3/2 , поскольку его проекция равна ms…
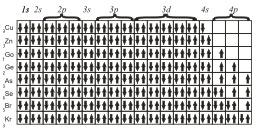
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром). Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем…

Открытие периодического закона и разработка Периодической системы химических элементов Д. И. Менделеевым явились вершиной развития химии в XIXв. Попытки классифицировать химические элементы имели место и до Менделеева. Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон: Свойства простых тел, а также формы и свойства соединений элементов…
Периодическая таблица и электронные конфигурации атомов

Из рассмотрения электронных конфигураций атомов наглядно прослеживается периодичность свойств элементов. Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением числа электронов на их внешних энергетических уровнях. По числу энергетических уровней атома элементы делятся на семь периодов….
Периодические свойства элементов

Периодичность свойств атомов элементов можно проиллюстрировать на самых разных их характеристиках. Перечислим важнейшие из них: радиус атома и атомный объем; потенциал ионизации; сродство к электрону; электроотрицательность атома (рис); степени окисления; физические свойства соединений (плотность, температуры плавления и кипения). Потенциал (энергия) ионизации I — энергия, необходимая для отрыва наиболее слабо связанного электрона от атома: X →…

Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может…
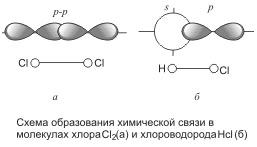
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода: Н + Н = Н2; ∆H = — 436 кДж/моль Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей) . В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако,…
