Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd — 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом
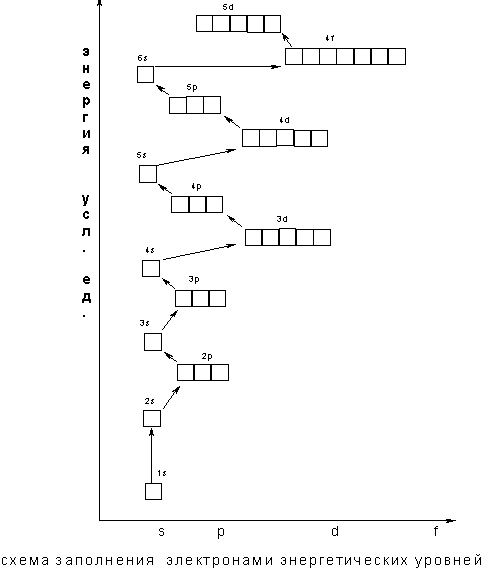
Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
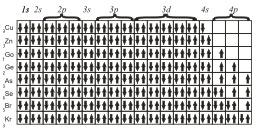
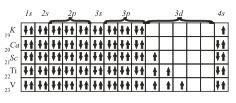 Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd.
Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd. 
Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так
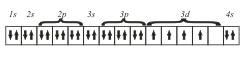
хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная (как и еще у одного элемента 29Сr).
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие
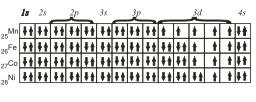
Наконец, последние восемь элементов четвертого периода имеют конфигурации
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
