Ковалентная связь
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
Н + Н = Н2; ∆H = — 436 кДж/моль
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей) 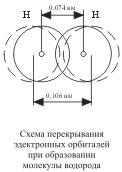 . В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение же плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
. В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение же плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы Н2) это расстояние составляет 0,074 нм . Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа гелия.
Изображать химические связи принято по-разному:
1) с помощью электронов в виде точек, поставленных у химического знака элемента. Тогда образование молекулы водорода можно показать схемой
H∙ + H∙ →H:H
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
1s1 1s1
↑ ↓
\ / или ↑ + ↓ → ↑↓
1s2
↑↓
Схема, расположенная слева, показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит, молекулярное состояние вещества более устойчиво, чем атомное;
3) часто, особенно в органической химии, ковалентную связь изображают черточкой (штрихом) (например, Н—Н), которая символизирует пару электронов.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов, или электронной пары:
Неподеленная Неподеленная
пара электронов, → ![]() ← пара электронов,
← пара электронов,
в атоме их 3 ↑ ↑ в молекуле их 6.
неспаренный общая или
электрон поделенная
пара электронов
Как видно, каждый атом хлора имеет три неподеленные пары и один неспаренный электрон. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, называемую также поделенной парой.
Если между атомами возникла одна ковалентняя связь (одна общая электронная пара), то она называется одинарной; если больше, то кратной двойной (две общие электронные пары), тройной (три общие электронные пары).
Одинарная связь изображается одной черточкой (штрихом), двойная — двумя, тройная — тремя. Черточка между двумя атомами показывает, что у них пара электронов обобщена, в результате чего и образовалась химическая связь. С помощью таких черточек изображают структурные формулы молекул.
Итак, в молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми электронов (s2p6), причем два из них (электронная пара) в одинаковой мере принадлежат обоим атомам. Перекрывание электронных орбиталей при образовании молекулы показано на рис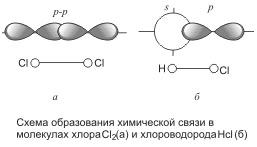
Несколько по-иному изображают связь в молекуле кислорода О2. Экспериментально установлено, что кислород является парамагнитным веществом (втягивается в магнитное поле). В его молекуле имеется два неспаренных электрона. Структуру этой молекулы можно изобразить так:
:О:О: или :О—О:
Одназначное решение об изображении электронной структуры молекулы кислорода еще не найдено. Однако ее нельзя изображать так:
:О::О: или О=O
В молекуле азота N2 атомы имеют три общие электронные пары:
:N: + :N: → :N::N:
Очевидно, молекула азота прочнее молекулы кислорода или хлора, чем и обусловлена значительная инертность азота в химических реакциях.
Химическая связь, осуществляемая электронными парами, называется ковалентной. Это двухэлектронная и двухцентровая (удерживает два ядра) связь. Соединения с ковалентной связью называются гомеополярными или атомными
