Электролиты и неэлектролиты
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора 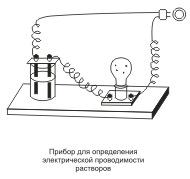 . Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид—ионы Cl—. Вода образует ионы водорода Н+ и гидроксид—ионы ОН— лишь в очень незначительных количествах.
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде диссоциируют на ионы.
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3∙H2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
К ним относятся:
