Свойства водорода
Физические свойства. Водород — это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен.
Кроме водорода с массовым числом 1 существуют изотопы с массовыми числами 2 и 3 — дейтерий D и тритий Т.
Химические свойства. В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1. Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов (или общего электронного облака):
Н:Н или Н2
Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж:
Н2 = 2Н, ∆H° = 436 кДж/моль
Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
Водород горит в кислороде с выделением большого количества теплоты. Температура водородно-кислородного пламени достигает 3000° С. Смесь двух объемов водорода и одного объема кислорода называется гремучим газом. При поджигании такая смесь дает сильный взрыв. Как при горении водорода в кислороде, так и при взрыве гремучей смеси образуется вода:
2Н2 + О2 = 2Н2О
При работе с водородом необходимо соблюдать большую осторожность, предварительно проверять герметичность аппаратуры, а также чистоту водорода перед его поджиганием.
При высокой температуре водород соединяется с щелочными и щелочноземельными металлами, образуя белые кристаллические вещества — гидриды металлов (LiН, NaН, КН, СаН2 и др.). В этих соединениях металл имеет положительную степень окисления, водород – отрицательную.
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
Повышенной реакционной способностью обладает атомный водород: при комнатной температуре он восстанавливает оксиды металлов, взаимодействует с кислородом, серой и фосфором. Горелка, работающая на атомном водороде, создает температуру выше 4000°С. Высокая температура обусловлена протеканием экзотермической реакции:
Н + Н = Н2, ∆H° = -436 кДж/моль
При нагревании водород восстанавливает многие металлы из их оксидов. Например,
CuO + H2 = Cu + H2O
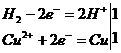
В этой реакции водород отдает один электрон (молекула водорода — два электрона), он — восстановитель:
Н – е— = Н+
Однако атом водорода может принимать один электрон (молекула — два электрона):
H + е— = Н—
Это происходит, например, при образовании гидридов металлов. В этом случае водород — окислитель.
