Пероксид водорода
Пероксид водорода (перекись водорода) Н2О2 — тяжелая полярная жидкость голубоватого цвета, строение которой показано на 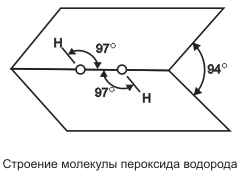 .
.
В жидком состоянии молекулы пероксида водорода сильно ассоциированы благодаря водородным связям. Поскольку пероксид водорода имеет больше возможностей к образованию таких связей (ввиду большего числа атомов кислорода на один атом водорода), чем вода, то он имеет большие плотность, вязкость и температуру кипения (150,2°С). Пероксид водорода смешивается с водой во всех отношениях, чистый Н2О2 и весьма концентрированные растворы взрываются на свету; 30%-ный раствор пероксида водорода в воде имеет техническое название «пергидроль».
Пероксид водорода каталитически разлагается при комнатной температуре, выделяя в первый момент атомарный кислород. На этом основано использование 3%-ного раствора Н2О2 в медицине.
Пероксид водорода вступает в реакции трех типов: без изменения пероксидной группировки:
Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О,
в качестве восстановителя:
2KMnО4 + 5Н2О2 + ЗН2SО4 = 2MnSО4 + К2SО4 + 5О2 + 8Н2O,
и, что более характерно, в качестве окислителя:
РbS + 4Н2О2 = PbSO4 + 4Н2О
В лаборатории пероксид водорода получают действием разбавленной серной кислоты на пероксид бария:
ВаО2 + Н2SО4 = ВаSО4↓+ Н2О2.
Пероксид водорода имеет разнообразное применение: для получения отбеливателей, вводимых в синтетические моющие средства; для получения различных пероксидов, особенно в органической химии; в реакциях полимеризации; для получения антисептических средств; для реставрации живописи на основе свинцовых красок.
