Общая характеристика
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат — радиоактивный элемент, изучен мало). Это р—элементы VII группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств.
Свойства элементов подгруппы галогенов
|
Свойства |
F |
Cl |
Br |
I |
At |
|
1. Порядковый номер |
9 |
17 |
35 |
53 |
85 |
|
2. Валентные электроны |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
6s26p5 |
|
3. Энергия ионизации атома, эВ |
17,42 |
12,97 |
11,84 |
10,45 |
9,2 |
|
4. Относительная электроотрицательность |
4,1 |
2,83 |
2,74 |
2,21 |
1,90 |
|
5. Степень окисления в соединениях |
-1 |
-1, +1, +3, +5, +7 |
-1, +1, +3, +5, +7 |
-1, +1, +3, +5, +7 |
-1, +1, +3, +5, +7 |
|
6. Радиус атома, нм |
0,064 |
0,099 |
0,114 |
0,133 |
— |
Они легко присоединяют по одному электрону, проявляя степень окисления —1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представитьсхемой
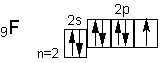
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р—подуровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1.
Электронное строение атома хлора выражается схемой
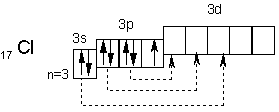
У атома хлора один неспаренный электрон на 3р—подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3d—подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома хлора электроны переходят с 3p — и 3s—подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений.
Водные растворы водородных соединений галогенов являются кислотами: НF — фтороводородная (плавиковая), НСl — хлороводородная (соляная), НВr — бромводородная, НI — йодоводородная.
