Получение
Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом.
При электролизе расплава хлорида натрия (Тпл = 801°С) на катоде выделяется металлический натрий, а на аноде — газообразный хлор. 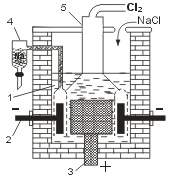
Электролитическая ванна (электролизер) представляет собой футерованный огнеупорным кирпичом стальной сосуд. В качестве анода используют графитовые стержни, в качестве катода — стальной цилиндр. В верхней части ванны имеется устройство для сбора хлора (колокол). Выделяющийся в катодном пространстве металлический натрий собирают в коллектор (устройство для сбора натрия без доступа воздуха). Таким образом, электролиз расплава NaCl — способ одновременного получения хлора и металлического натрия.
Электролизом водного раствора NаСl получают одновременно Н2, Сl2 и гидроксид натрия NаОН. Обычно электролизу подвергают насыщенный водный раствор NaCl (рассол), подаваемый в электролизер сверху.
Электролиз протекает по следующей схеме:
| NaCl |
||
| Н2О |
||
| ↓ ↓ ↓ | ||
| (-) Катод | (+) Анод | |
| 2Н+ + 2е = Н2↑ | 2Н+ + 2е = Н2↑ 2Cl — 2e = Cl2 | |
| 2NaCl + 2Н2О = Н2↑ + 2NaОН + Сl2↑. | ||
В этом процессе требуется предотвратить соприкосновение выделяющегося на аноде хлора с накапливающимся у катода раствором гидроксида натрия (получающийся в этом случае NaOH имеет давнее техническое название «каустическая сода»), так как эти вещества могут реагировать между собой. Именно по этой причине анодное пространство обязательно отделяется от катодного полупроницаемой диафрагмой из асбеста 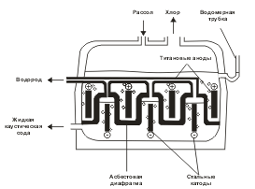 . Диафрагма препятствует проникновению газа (молекул Сl2) в катодное пространство, но не препятствует прохождению электрического тока и ионов.
. Диафрагма препятствует проникновению газа (молекул Сl2) в катодное пространство, но не препятствует прохождению электрического тока и ионов.
Для получения брома и йода также можно использовать электролиз их солей, однако на практике обычно окисляют их соли, применяя в качестве окислителя хлор. Такой метод оказывается выгодным экономически, так как Сl2 сравнительно дешевый реагент, а иодиды, и особенно бромиды, просто «черпают» из морской воды (!).
Лабораторные способы получения галогенов. Хлор получают действием различных окислителей на соляную кислоту, например:
МnО2 + 4НСl = МnСl2 + Сl2↑ + 2Н2О.
Еще более эффективно окисление проводится такими окислителями, как РbО2, КМnО4, КСlO3, К2Сr2О7.
Аналогично получают в лабораториях бром и иод, окисляя НВr, НI или их соли. В качестве примера кратко опишем здесь практически используемую лабораторную методику получения брома по реакции:
6КВr + К2Сr2О7 +7Н2SО4 = ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О.
В колбу 1 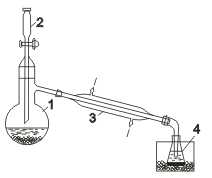 соединенную с холодильником 3 и приемником 4, помещают смесь бромида калия и бихромата калия капельной воронки 2, пришлифованной к горлу колбы, приливают по каплям концентрированную серную кислоту. Реакционная смесь в ходе реакции разогревается, и ввиду низкой температуры кипения брома для конденсации его паров применяют холодильник, непрерывно охлаждаемый проточной водой. Жидкий бром собирают под слоем воды, предварительно охлажденной снегом или охладительной смесью.
соединенную с холодильником 3 и приемником 4, помещают смесь бромида калия и бихромата калия капельной воронки 2, пришлифованной к горлу колбы, приливают по каплям концентрированную серную кислоту. Реакционная смесь в ходе реакции разогревается, и ввиду низкой температуры кипения брома для конденсации его паров применяют холодильник, непрерывно охлаждаемый проточной водой. Жидкий бром собирают под слоем воды, предварительно охлажденной снегом или охладительной смесью.
