Получение. Свойства.
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана (C5 — C17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов — нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при
нагревании:
| tº. Ni | ||
| СН3-СН=СН2 + Н2 | → | СН3-СН2-СН3, |
СНз—C≡СН + 2Н2 → СН3-СН2-СН3.
2. Получение из галогенпротводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
С2Н5Br + 2Na + Br—C2H5 → C2H5—C2H5 + 2NaBr.
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
| t° | ||
| CH3COONa + NaOH | → | СН4↑ + Na2CO3. |
4.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н2 → СН4.
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
Аl4С3 + 12Н2О = ЗСН4↑ + 4Аl(ОН)3.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия KMnО4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью s—связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ, substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
| Сl2 | Сl2 | Сl2 | Сl2 | |||||||
| СН4 | → | СН3Сl | → | СН2Сl2 | → | СНСl3 | → | ССl4 | (*) | |
| -HCl | -HCl | -НСl | -HCl |
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи:
| hv | ||
| Сl2 | → | 2Сl· |
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl·+ СН4→НСl + СН3·
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3· + Сl2→СН3Сl + Сl·
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl· + Cl· → Сl2, СН3· + СН3· → С2Н6, СН3· + Cl· → СН3Сl·
Суммарное уравнение реакции:
| hv | ||
| СН4 + Сl2 | → | СН3Сl + НСl. |
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH2Cl2, CHCl3, ССl4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
| t ° | ||
| CH3-CH3 + HNO3 | → | CH3-CH2-NO2 + H2O. |
При радикальных реакциях (галогенирование, нитрование) в первую очередь замешаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем — вторичного (390 кДж/моль) и только потом — первичного (415 кДж/моль).
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
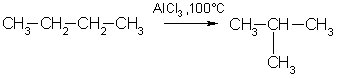
4. Крекинг — это гемолитический разрыв связей С-С, который протекает при нагревании и под действием катализаторов.
При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
C8H18 → C4H10 + С4Н8,
2СН4 → С2Н2 + ЗН2,
С2Н6 → С2Н2 + 2Н2.
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
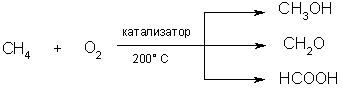 |
Мягкое каталитическое окисление бутана кислородом воздуха — один из промышленных способов получения уксусной кислоты:
t°
2C4H 10 + 5O2 → 4CH3COOH + 2Н2О .
кат
На воздухе алканы сгорают до СО2 и Н2О:
СnН2n+2 + (Зn+1)/2О2 = nСО2 + (n+1)Н2О.
