Получение. Свойства
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 — С4 — газы. С5 – С15 — жидкости, начиная с C16 — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
| t | ||
| С8Н18 | → | С4Н10 + С4Н8 |
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов — дегидрирование алканов:
| t, Cr2O3 | ||
| СН3-СН2-СН3 |
→
|
СН3-СН=СН2 + Н2 |
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь. К таким реакциям относятся следующие.
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
| H2SO4 | ||
| СН3-СН2-ОН |
→
|
СН2=СН2 + Н2О |
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
| С2Н6ОН | ||
| СН3-СН2-СНВr-СН3 + КОН |
→
|
СН3-СН=СН-СН3 + КВr + Н2О |
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
CH2Br—CHBr—CH3 + Mg → СН2=СН-СН3 + MgВr2.
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность p-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом AE(от англ, addition electrophilic). Реакции злектрофильного присоединения это ионные процессы, протекающие в несколько стадий.
На первой стадии электрофильная частица (чаще всего это бывает протон H+) взаимодействует с p-электронами двойной связи и образует p-комплекс, который затем превращается в карбокатион путем образования ковалентной s-связи между электрофильной частицей и одним из атомов углерода:
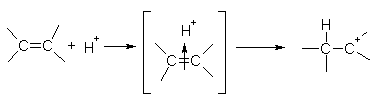
алкен p-комплекс карбокатион
На второй стадии карбокатион реагирует с анионом X—, образуя вторую s-связь за счет электронной пары аниона:
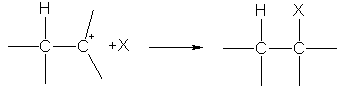
Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. Распределение зарядов определяется смещением p-электронной плотности под влиянием заместителей: 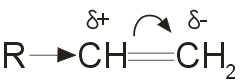 .
.
Электронодонорные заместители, проявляющие +I -эффект, смещают p-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд. Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ(X= Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды:
СН3-СН=СН2 + НВr ® СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
| R-O-O-R | ||
| СН3-СН=СН2 + НВr |
→
|
СН3-СН2-СН2Вr |
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН ® СН3-СН(ОН)-СН3.
3) Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 ® ВrСН2-СН2Вr.
Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
| t, Ni | ||
| СН3-СН=СН2 + Н2 |
→
|
СН3-СН2-СН3 |
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АE:
| Н* | ||
| nCH2=CHR |
→
|
(-CH2-CHR-)n |
где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение — полимером , число n-степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
ЗСН2=СН2 + 2КМnО4 + 4Н2О ® ЗНОСН2-СН2ОН + 2MnO2↓ + 2KOH.
В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
| [О] | ||
| СН3-СН=СН-СН3 |
→
|
2СН3-СООН |
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
СnН2n + Зn/2О2 ® nСО2↑ + nН2О.
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
СnН2n + nО2 ® nCO↑ + nH2O.
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:
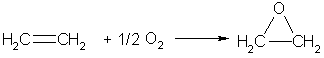
При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлор-метане при температурах ниже комнатной, то происходит реакция присоединения, и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой — при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
Низшие алкены — важные исходные вещества для промышленного органического синтеза. Из этилена получают этиловый спирт, полиэтилен, полистирол. Пропен используют для синтеза полипропилена, фенола, ацетона, глицерина.
