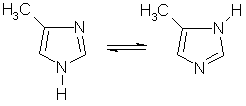Пиррол. Химические свойства
1. Сильные минеральные кислоты моут вытягивать электронную пару атома азота из ароматической системы, при этом ароматичность нарушается, и пиррол превращается в неустойчивое соединение, которое сразу полимеризуется. Неустойчивость пиррола в кислой среде называется «ацилофобностью».
2. Пиррол проявляет свойства очень слабой кислоты. Он реагирует с калием, образуя пирролкалий:
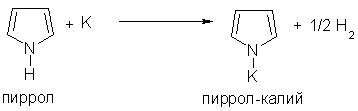
3. Пиррол как ароматическое соединение склонен к реакциям электрофильного замещения, которые протекают преимущественно у α-атома углерода (соседнего с атомом азота). Поскольку пиррол под действием кислот полимеризуется, то для проведения замещения используют реагенты, не содержащие протонов.
Так, для нитрования пиррола используют ацетилнитрат:
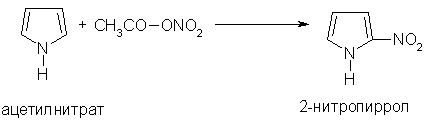
а для сульфирования — комплекс пиридина с оксидом серы (VI):
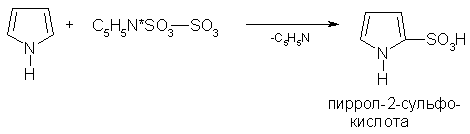
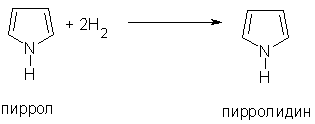
4. При гидрировании пиррола образуется пирролидин — циклический вторичный амин, проявляющий значительные основные свойства.
Интересными свойствами обладают пятичленные ароматические гетероциклы, содержащие два атома азота, — имидазол и пиразол C3H4N2:
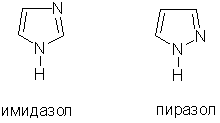
Эти соединения амфотерны. Один атом азота (пиридинового типа) в них проявляет слабые основные свойства и способен принимать протон, а другой атом азота (пиррольного типа) входит в состав группы NH, которая проявляет слабые кислотные свойства и способна отдавать протон. Благодаря этому появляется возможность переноса протона между двумя атомами азота, и некоторые производные имидазола и пиразола могут существовать в виде быстро переходящих друг в друга таутомерных форм: