Изомерия. Физические свойства
Изомерия. У карбоновых кислот возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
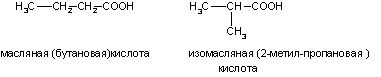
2. Изомерия положения кратной связи, например:
СН2=СН—СН2—СООН СН3—СН=СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кретоновая кислота)
3. Цис-транс- изомерия, например:
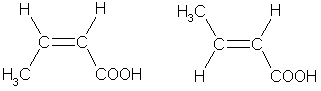
цис -бутен-2-овая транс-бутен-2-овая
кислота кислота
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—СН2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СН3) и этиловый эфир уксусной кислоты (СН3—СО—О—СН2—СН3).
5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты:
СН3—СН2—СНСl—СООН СН3—СНСl—СН2—СООН
2-хлорбутановая кислота 3-хлорбутановая кислота
СН2Сl—СН2—СН2—СООН
4-хлорбутановая кислота
Для гетерофункциональных кислот возможна также оптическая изомерия.
Физические свойства. Насыщенные алифатические монокар-боновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1 COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
Физические свойства карбоновых кислот
| Название кислоты | Химическая формула |
tпл | tкип | Чсло Двойных Связей |
|
Муравьиная(метановая) |
HCOOH |
8 |
101 |
0 |
|
Уксусная(этановая) |
CH3COOH |
17 |
118 |
0 |
|
Пропионовая(пропановая) |
CH3CH2COOH |
-22 |
141 |
0 |
|
Акриловая(пропеновая) |
CH2=CH-COOH |
12 |
141 |
1 |
|
Капроновая(гексановая) |
CH3(CH2)4COOH |
-2 |
205 |
0 |
| Пальмитиновая (гексадециловая) |
C15H31COOH | 64 | 215 | 0 |
|
Стеариновая(октадециловая) |
C17H35COOH |
70 |
232 |
0 |
| Олеиновая (цис-октадецен-9-овая) |
C17H33COOH | 14 | 228 | 1 |
| Линолевая (октадекадиен-9,12-овая) |
C17H31COOH |
-5 |
230 |
2 |
| Линоленовая (октадекатриен-9,12,15-овая) | C17H29COOH |
-11 |
230 |
3 |
|
Бензойная(бензолкарбоновая) |
C6H5COOH |
122 |
249 |
0 |
|
Щавелевая(этандиовая) |
HOOC—COOH |
190 |
0 |
При одной и той же длине углеводородного радикала температуры плавления (и кипения) зависят от наличия кратных связей — с ростом их числа соответствующие температуры уменьшаются.
Ненасыщенные кислоты при комнатной температуре являются, как правило, жидкостями.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
